Utilizando los mismos criterios de racionalización del gasto
público, la CIPM también ha emitido
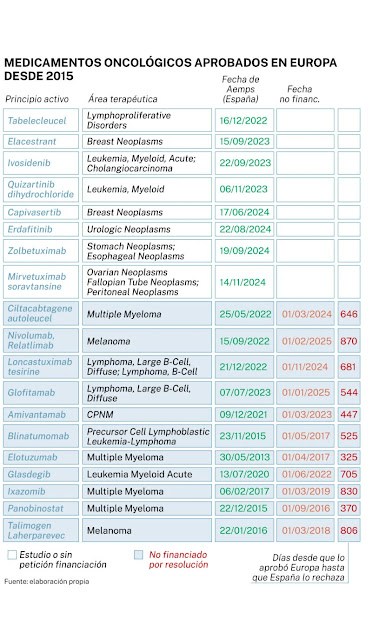
dictamen de no financiación para glofitamab, indicado en monoterapia para
el tratamiento de pacientes adultos con linfoma B difuso de células grandes
(Lbdcg) en recaída o refractario, después de dos o más líneas de tratamiento
sistémico. La decisión de denegar la financiación se tomó en la reunión del 26
de septiembre de 2024 en los siguientes términos: «La Comisión acuerda proponer
a la Dirección General la no inclusión en la prestación farmacéutica del SNS,
teniendo en cuenta el valor terapéutico y social del medicamento y beneficio
clínico incremental del mismo teniendo en cuenta su relación coste-efectividad,
así como criterios de racionalización del gasto público destinado a prestación
farmacéutica».
La misma suerte ha corrido
la combinación premezclada de nivolumab y relatlimab, un anticuerpo monoclonal
indicado para el tratamiento en primera línea del melanoma avanzado
(irresecable o metastásico) a partir de 12 años de edad con expresión de PD-L1
menor 1% en las células tumorales. Según consta en el documento donde se
recogen los acuerdos de la CIPM reunida el 17 de julio de 2024, «la Comisión
acuerda proponer a la Dirección General la no inclusión en la prestación
farmacéutica, teniendo en cuenta criterios de racionalización del gasto público
destinado a prestación farmacéutica».
La falta de financiación y, por tanto, accesibilidad, afecta a 19
medicamentos de todos los aprobados por la EMA desde 2015. De ellos, once ya
han recibido la negativa a ser financiados. Entre ellos, ciltacabtagene
autoleucel, loncastuximab tesirine, amivantamab, elotuzumab, glasdegib,
ixaxomib, panobinostat y talimogen laherparepvec. Solo en tres de ellos
(glasdegib, ixaxomib, panobinostat), constan específicamente cuestiones clínicas
como argumento.
Las negativas se han ido produciendo desde 2016 hasta finales de 2024 y afectan, principalmente, al mieloma múltiple. También se han denegado alternativas para pacientes con linfoma B difuso de células grandes, cáncer de pulmón no microcítico, melanoma o leucemia mieloide aguda. Teniendo en cuenta todos ellos, se calcula una media de 614 días desde que el fármaco fuera aprobado en Europa hasta que el CIMP emitiera un juicio sobre su financiación. Los nueve restantes se encuentran en estudio o sin petición de financiación.
Retrasos en España
Según el informe Indicadores de acceso a terapias innovadoras en Europa
2023 (W.A.I.T Indicator), elaborado por la consultora Iqvia para la Federación
Europea de la Industria Farmacéutica (EFPIA), entre 2019 y 2022, la EMA
autorizó 167 nuevos fármacos. De estos, España había incorporado a la
financiación pública, hasta enero de 2024, un total de 103, lo que
representa el 62% de los autorizados.
Así las cosas, los
pacientes españoles tardan años en acceder a medicamentos que en otros países
de Europa ya forman parte del arsenal terapéutico estándar. Este retraso no
solo genera desigualdad en el acceso a tratamientos innovadores con respecto a
nuestros vecinos europeos, sino que también genera una brecha dentro del propio
sistema sanitario español, donde el acceso a ciertos medicamentos se convierte
en una lotería hospitalaria. Es decir, el acceso a ciertos tratamientos depende
de la capacidad de los hospitales para sortear barreras burocráticas y
gestionar su adquisición.
Fuente documental: La Razón
No hay comentarios:
Publicar un comentario